¿Qué es el Modelo de Thomson? 🥇Origen, características, importancia y críticas
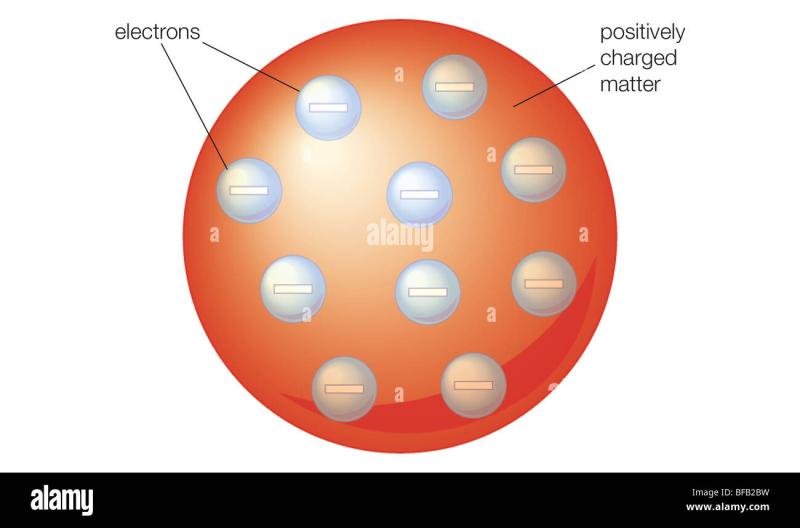
El Modelo de Thomson es una teoría científica propuesta por el físico británico Joseph John Thomson en 1897. Este modelo describe la estructura del átomo como una esfera uniforme de carga positiva en la que se encuentran incrustados los electrones de manera uniforme. Thomson basó su teoría en sus experimentos con tubos de rayos catódicos, en los que descubrió la existencia de partículas subatómicas con carga negativa, a las que llamó electrones.
Este modelo fue revolucionario en su época, ya que contradecía la teoría del átomo indivisible de Dalton y sentó las bases para el posterior desarrollo del modelo atómico de Rutherford. Aunque el Modelo de Thomson fue reemplazado por modelos más complejos y precisos, su importancia radica en haber sido el primer intento.
- Origen del Modelo de Thomson
- Principales características del Modelo de Thomson
- Importancia del Modelo de Thomson en la historia de la física
- Limitaciones y críticas al Modelo de Thomson
-
Conclusión
- ¿Quién fue J.J. Thomson?
- ¿En qué año se propuso el Modelo de Thomson?
- ¿Cuál fue la principal contribución del Modelo de Thomson a la física?
- ¿Cómo influyó el descubrimiento del electrón en el Modelo de Thomson?
- ¿Cuáles son las principales diferencias entre el Modelo de Thomson y el Modelo de Rutherford?
Origen del Modelo de Thomson
El Origen del Modelo de Thomson: Una Teoría Revolucionaria
El modelo de Thomson, también conocido como el modelo del "budín de pasas", fue propuesto por el físico británico Joseph John Thomson en 1897. Este modelo revolucionario cambió la forma en que entendemos la estructura del átomo y sentó las bases para futuras investigaciones en el campo de la física.
Antes del modelo de Thomson, se creía que el átomo era una esfera sólida e indivisible.
Sin embargo, Thomson demostró que el átomo estaba compuesto por partículas más pequeñas llamadas electrones, distribuidos uniformemente en una masa positiva. Esta teoría desafiaba las creencias establecidas y abrió la puerta a nuevas posibilidades en la investigación científica.
Un Experimento Crucial
Thomson llegó a su teoría después de realizar un experimento con tubos de rayos catódicos, donde descubrió que los rayos estaban compuestos por partículas cargadas negativamente.
A partir de este descubrimiento, pudo determinar la relación entre la carga y la masa de los electrones, lo que lo llevó a desarrollar su modelo del átomo.
Este experimento fue crucial para el desarrollo del modelo de Thomson y sentó las bases para futuras investigaciones sobre la estructura del átomo.
Además, su teoría fue confirmada posteriormente por otros científicos, lo que le otorgó aún más credibilidad y relevancia en el campo de la física.
Un Legado Duradero
Aunque el modelo de Thomson fue reemplazado por el modelo atómico de Rutherford en 1911, su contribución a la ciencia es innegable.
Su teoría abrió la puerta a nuevas investigaciones y avances en el campo de la física, y su experimento sigue siendo un ejemplo clásico de cómo la observación y la experimentación pueden llevar a descubrimientos revolucionarios.
En resumen, el modelo de Thomson es una pieza.
Principales características del Modelo de Thomson
El Modelo de Thomson es una teoría científica desarrollada por el físico británico J.J. Thomson en el siglo XIX. Esta teoría revolucionaria propone que los átomos están compuestos por partículas más pequeñas llamadas electrones, distribuidos en una nube positiva de carga eléctrica. A continuación, se presentan las principales características de este modelo:
1. Estructura del átomo: Según el Modelo de Thomson, el átomo está formado por una esfera positiva de carga eléctrica, en la cual se encuentran incrustados los electrones de manera uniforme.
Esta estructura difiere de la teoría anterior, que consideraba al átomo como una esfera maciza e indivisible.
2. Presencia de electrones: Una de las principales aportaciones del Modelo de Thomson fue la existencia de los electrones, partículas con carga negativa que se encuentran en constante movimiento alrededor del núcleo del átomo.
3. Neutralidad eléctrica: A pesar de la presencia de cargas positivas y negativas en el átomo, el Modelo de Thomson establece que éste es eléctricamente neutro debido a que la cantidad de electrones y protones es igual.
4.
Descubrimiento del electrón: Gracias a sus investigaciones sobre la conductividad eléctrica en gases, Thomson pudo demostrar la existencia de los electrones y su papel fundamental en la estructura del átomo.
5. Base para futuras teorías: Aunque el Modelo de Thomson fue reemplazado por el Modelo Atómico de Rutherford, su aporte fue fundamental para entender la estructura del átomo y sentar las bases para futuras teorías sobre la materia.
En resumen, el Modelo de Thomson es una teoría que revolucionó la forma en que se entendía la estructura del átomo.
Su descubrimiento del electrón y su propuesta de una estructura atómica con cargas positivas y negativas sentaron las bases para futuras investigaciones en el campo de la física. A pesar de haber sido reemplazado por otras teorías, su importancia en la historia de la ciencia es innegable.
Importancia del Modelo de Thomson en la historia de la física
La Importancia del Modelo de Thomson en la Historia de la Física
El modelo de Thomson, también conocido como el modelo del pudín de pasas, fue propuesto por el físico británico Joseph John Thomson en 1904. Este modelo revolucionario fue uno de los primeros intentos de explicar la estructura interna del átomo y sentó las bases para futuras investigaciones en el campo de la física.
Antes del modelo de Thomson, se creía que el átomo era una esfera sólida e indivisible. Sin embargo, Thomson demostró que el átomo estaba compuesto por partículas más pequeñas llamadas electrones, distribuidas uniformemente en una esfera de carga positiva.
Este descubrimiento desafió las creencias establecidas y abrió la puerta a nuevas teorías y experimentos.
Impacto en la Física Moderna
El modelo de Thomson fue un avance significativo en la comprensión del átomo y sentó las bases para el desarrollo del modelo atómico moderno. Su teoría fue ampliamente aceptada y sirvió como punto de partida para otros científicos, como Ernest Rutherford y Niels Bohr, quienes construyeron sobre sus ideas y desarrollaron modelos más complejos del átomo.
Además, el modelo de Thomson tuvo un impacto en otras áreas de la física, como la electromecánica y la física cuántica. Sus investigaciones sobre los electrones también contribuyeron al desarrollo de tecnologías como los tubos de rayos catódicos y los televisores.
Legado de Thomson
Aunque el modelo de Thomson fue reemplazado por modelos más precisos a medida que avanzaba la investigación, su importancia en la historia de la física es innegable. Su teoría desafió las creencias establecidas y abrió nuevas puertas para la exploración y el descubrimiento.
Sin duda, Thomson fue un pionero en su campo y su legado continúa inspirando a futuras generaciones de científicos.
Limitaciones y críticas al Modelo de Thomson
Limitaciones y críticas al Modelo de Thomson
El Modelo de Thomson, también conocido como el modelo del átomo de pudín, fue propuesto por el físico británico Joseph John Thomson en 1904.
Aunque este modelo fue un gran avance en la comprensión de la estructura atómica, también ha sido objeto de críticas y limitaciones a lo largo de los años.
Limitaciones
Una de las principales limitaciones del Modelo de Thomson es que no explica la presencia de partículas subatómicas como los protones y neutrones en el núcleo del átomo.
Además, este modelo no puede explicar la distribución de carga eléctrica en el átomo, ya que se basa en un átomo con una carga positiva uniforme.
Críticas
Otra crítica al Modelo de Thomson es que no tiene en cuenta la naturaleza ondulatoria de los electrones, lo que se demostró posteriormente con el experimento de difracción de electrones realizado por Clinton Davisson y Lester Germer en 1927.
Además, este modelo no puede explicar la estabilidad del átomo, ya que según las leyes de la física clásica, un electrón en movimiento debería emitir energía y eventualmente colapsar en el núcleo.
Insights valiosos
A pesar de sus limitaciones y críticas, el Modelo de Thomson fue un gran avance en la comprensión de la estructura atómica y sentó las bases para futuras investigaciones y descubrimientos.
Además, este modelo ayudó a establecer la idea de que los átomos están compuestos por partículas más pequeñas y que la carga eléctrica es una propiedad fundamental de los átomos. Aunque ha sido reemplazado por modelos más precisos, el Modelo de Thomson sigue siendo un hito en la historia de la ciencia.
Conclusión
El Modelo de Thomson fue propuesto por el físico británico J.J. Thomson en 1897 y revolucionó la comprensión de la estructura atómica. Este modelo postulaba que los átomos estaban compuestos por una esfera positiva con electrones incrustados en ella, similar a las pasas en un pudín. Esta teoría reemplazó la idea previa de que los átomos eran indivisibles y homogéneos.
Aunque el modelo de Thomson fue posteriormente reemplazado por el modelo de Rutherford, sentó las bases para futuras investigaciones sobre la estructura atómica y la evolución de la teoría atómica. Su impacto en la ciencia moderna sigue siendo relevante hoy en día.
¿Quién fue J.J. Thomson?
J.J. Thomson fue un físico británico que descubrió el electrón en 1897, lo que revolucionó la comprensión de la estructura atómica. Su experimento con tubos de rayos catódicos demostró que los átomos no eran indivisibles, sino que contenían partículas subatómicas cargadas negativamente. Este hallazgo sentó las bases para el posterior desarrollo del modelo atómico de Rutherford y Bohr.
¿En qué año se propuso el Modelo de Thomson?
El modelo de Thomson, también conocido como el modelo del átomo de pudín, fue propuesto en 1904 por el físico británico Joseph John Thomson. Este modelo revolucionario planteaba que los átomos estaban compuestos por electrones incrustados en una esfera de carga positiva. Fue un gran avance en la comprensión de la estructura atómica y sentó las bases para futuras investigaciones en el campo de la física.
¿Cuál fue la principal contribución del Modelo de Thomson a la física?
La principal contribución de Thomson fue su descubrimiento de los electrones, partículas subatómicas con carga negativa que forman parte de la estructura de los átomos. Esto revolucionó la física al demostrar que los átomos no eran indivisibles, como se creía anteriormente, y sentó las bases para el desarrollo de la teoría atómica moderna. Además, su modelo del átomo como una esfera con carga positiva y electrones incrustados permitió explicar fenómenos como la conductividad eléctrica y la emisión de luz en los gases.
¿Cómo influyó el descubrimiento del electrón en el Modelo de Thomson?
El descubrimiento del electrón en 1897 por parte de J.J. Thomson revolucionó la comprensión de la estructura atómica al demostrar que los átomos no eran indivisibles. Esto llevó a la creación de nuevos modelos atómicos y a la comprensión de la existencia de partículas subatómicas, lo que cambió por completo la forma en que se entendía la materia y sus propiedades. Además, este descubrimiento sentó las bases para futuros avances en la física y la química, permitiendo un mayor entendimiento del mundo a nivel microscópico.
¿Cuáles son las principales diferencias entre el Modelo de Thomson y el Modelo de Rutherford?
El Modelo de Thomson y el Modelo de Rutherford son dos teorías que explican la estructura del átomo. La principal diferencia entre ellos radica en la ubicación de los electrones: mientras que en el Modelo de Thomson se encuentran distribuidos uniformemente en una esfera positiva, en el Modelo de Rutherford se concentran en órbitas alrededor del núcleo. Además, el Modelo de Rutherford introduce la idea de un núcleo atómico denso y cargado positivamente, lo que permite explicar la dispersión de partículas alfa en su famoso experimento.
En resumen, el Modelo de Thomson es más simplista y no tiene en cuenta la estructura interna del átomo, mientras que el Modelo de Rutherford es más complejo y se basa en evidencia experimental.
